
Ceruchus piceus (Weber 1801)
Par Khalil ABAS et Margaux DUBÉ
Texte et photographies ©2016 CC BY-SA 4.0, les auteurs
L’espèce Ceruchus piceus (Figure 1) a été décrite pour la première fois en 1801, par l’entomologiste allemand Friedrich Weber (1781-1823), dans son deuxième ouvrage intitulé “Observationes entomologicae“.

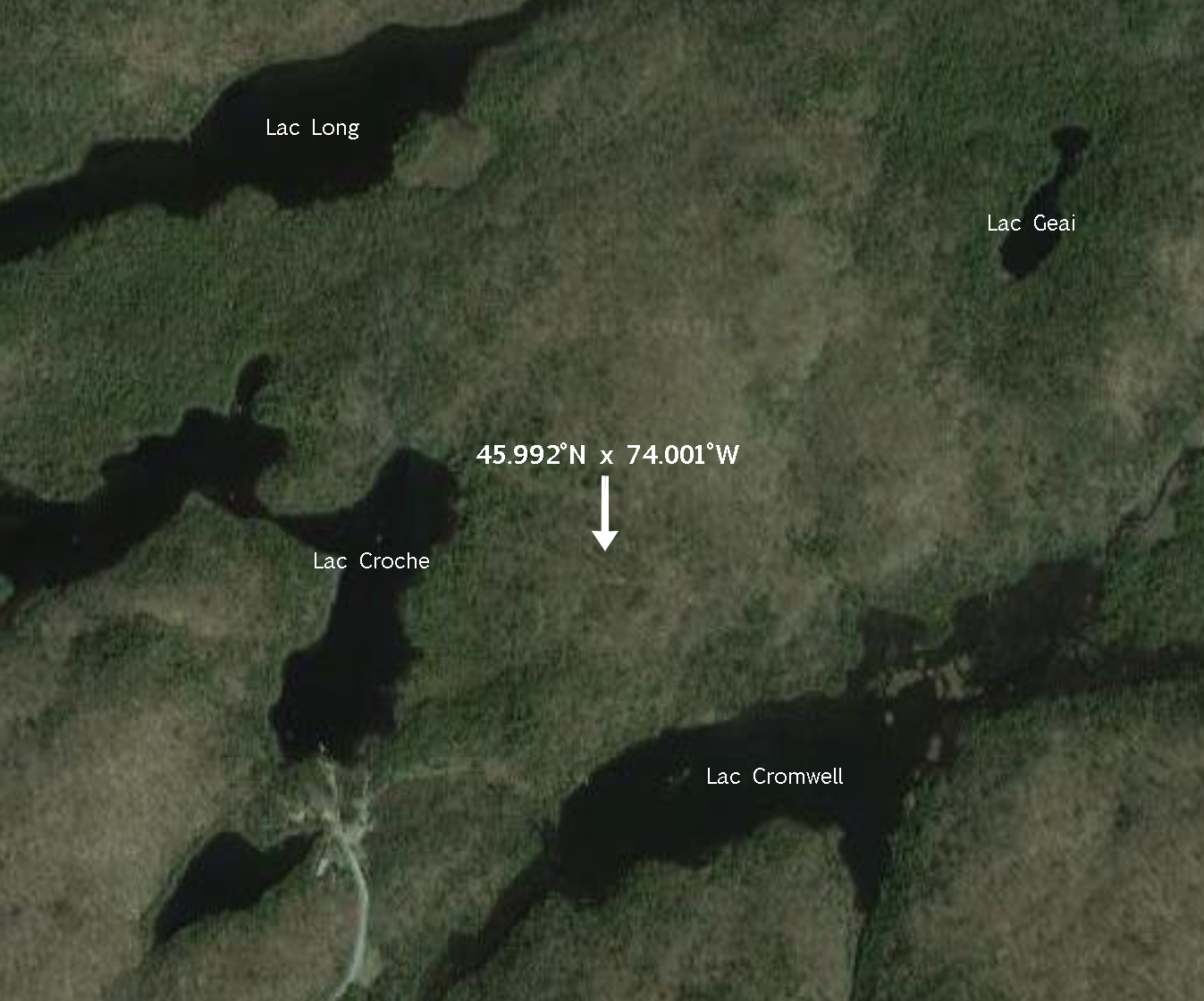
Le spécimen a été collecté à la main dans une souche de bois en décomposition (Figure 2) à proximité du sentier en direction du lac Geai au site 3 : 45.992°N,74.001°W le 1er septembre 2016 à la Station de biologie des Laurentides (SBL) (Figure 3). Ce territoire faisant parti du domaine climacique de l’érablière à bouleaux jaunes est caractérisé par des forêts mixtes. Plus particulièrement, le lieu de collecte se situe dans une communauté perturbée dominée par le bouleau blanc et le peuplier à grandes dents (Savage, 2001).

Classification
Embranchement : Arthropoda
Sous-Embranchement : Hexapoda
Classe : Insecta
Ordre : Coleoptera
Super-Famille : Scarabaeoidea
Famille : Lucanidae
Sous-Famille : Syndesinae
Genre : Ceruchus
Espèce : Ceruchus piceus
Identification
Afin de pouvoir identifier le spécimen de manière précise, il a été nécessaire d’utiliser différentes clés d’identification (Hardy, 2014; VanDyk, 2015). Le processus a été relativement facile puisque le spécimen comporte des caractères spécifiques faciles à observer et il y a peu d’autres espèces du même genre en Amérique du Nord.
Tout d’abord, en observant sa morphologie générale, on remarque immédiatement ses élytres, caractère apomorphique de l’ordre des Coleoptera (Figure 4 – 1). Ce sont les ailes antérieures qui ont été modifiées pour protéger les ailes postérieures et l’abdomen. En général, on remarque également un grand prothorax et des pièces buccales broyeuses, des caractères plésiomorphiques pour cet ordre.

Le spécimen appartient à la super-famille des Scarabaeoidea. En effet, son prothorax élargi est modifié pour faciliter le fouissage avec des coxas larges et on peut aussi voir que ses pro-tibia sont dentés, caractéristique des pattes fouisseuses (Figure 4 – 2,3,4). De plus, les antennes sont lamelliformes, bien que peu visibles dans notre cas. La super-famille Scarabaeoidea correspond à un ensemble diversifié et cosmopolite d’insectes (on en retrouve même en Arctique) avec plus de 30 000 espèces connues. Elle comprend les coléoptères les plus familiers puisqu’ils sont de large taille, de couleurs souvent vives et qu’ils peuvent avoir une certaine importance culturelle. Par exemple, ils avaient une place importante dans la mythologie égyptienne (Arnett et al., 2002).
Cette super-famille est divisée en douze familles, dont onze se retrouvent en Amérique du Nord. L’élément clé qui a permis de déterminer que le spécimen appartient à la famille Lucanidae est la morphologie des antennes. Celles-ci ont la particularité d’avoir des lamelles immobiles, écartées les unes des autres et très peu aplaties (Arnett, R. H. et JR., 1968) (Figure 5 – 5), alors que les autres familles ont des antennes avec des lamelles plus aplaties, collées les unes sur les autres, et qui peuvent s’ouvrir en éventail. Les Lucanidés partagent ce caractère avec deux autres familles : Passalidae et Diphyllostomatidae, sauf que certains autres caractères permettent de les distinguer facilement. Passalidae a une strie centrale sur le prothorax, des élytres profondément striés et une corne dorso-médiane. Diphyllostomatidae est relativement poilu et se retrouve seulement sur la côte ouest (Scholtz, 1990).

Normalement, les Lucanidés sont aussi caractérisés par leurs antennes géniculées. Cependant, une de ses sous-familles, les Syndesinae, à laquelle le spécimen appartient, est une exception où les antennes sont non géniculées (Figure 6 – 6) (Arnett et al., 2002).

Cette sous-famille compte deux genres : Ceruchus et Sinodendron. Le genre Sinodendron est caractérisé par une corne céphalique chez le mâle et un tubercule médian chez la femelle. De plus, on le retrouve seulement sur la côte ouest de l’Amérique du nord. Le genre Ceruchus, quant à lui, n’a ni corne ni tubercule et il compte sept espèces, dont trois en Amérique du Nord. On en retrouve deux à l’Ouest du continent et une à l’Est (Ratcliffe, 1991). C’est ainsi que l’on peut déduire que le spécimen est Ceruchus piceus, le seul Syndesinae connu au Québec.
Il a été facile de déterminer que le spécimen est une femelle puisque comme pour tous les Lucanidés, Ceruchus piceus a un dimorphisme sexuel marqué, principalement au niveau des mandibules. La femelle a de petites mandibules (Figure 6 – 7), son pronotum est plus arrondi que celui du mâle (qui est rectangulaire) et les stries sur ses élytres sont fortement ponctuées. Le mâle, quant à lui, a de grandes mandibules allométriques, c’est-à-dire proportionnelles à la taille de son pronotum, et ayant chacune deux dents sur la marge interne. C’est d’ailleurs de là que les Lucanidés tirent leur nom commun en anglais : « Stag beetle », qui réfère aux bois de cerf. Ces mandibules sont utiles pour le combat contre les autres mâles durant la période de reproduction. De plus, la tête du mâle a des crêtes sur les côtés et une large dépression au centre, ce qui est absent chez la femelle (Ratcliff, 1991)
Description
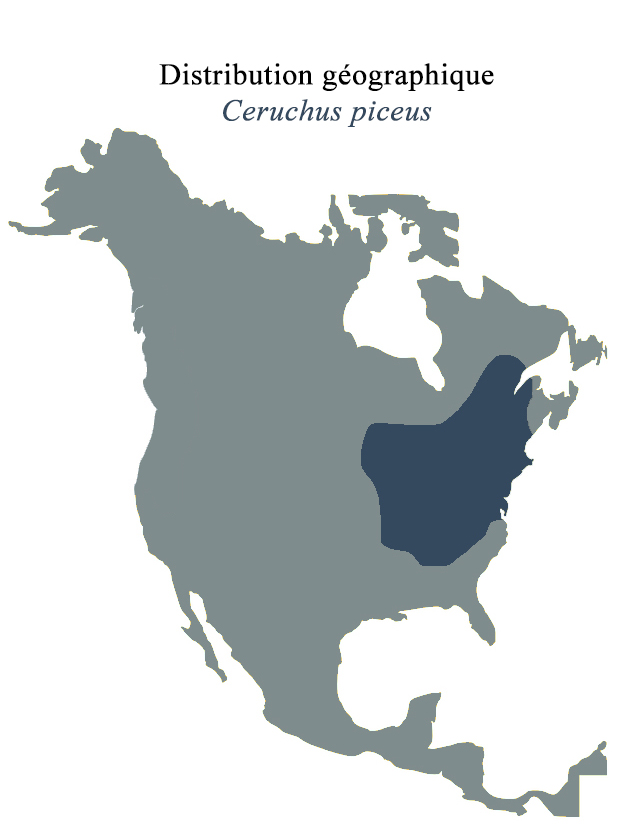
Ceruchus piceus est un petit Lucanidé de 10 à 14 millimètres de long (sans les mandibules). La coloration des adultes va du noir au brun rouge foncé (Hardy, 2014). Chacun des deux élytres possède cinq stries avec des intervalles ponctués. Il vit dans les arbres étant à leur deuxième ou troisième stade de décomposition (Daggy, 1946). On le retrouve sur plusieurs essences d’arbres : le bouleau, le pin, l’aulne, le cerisier tardif (Hoffman, 1937) et le chêne (Blatchley, 1910). Il occupe la partie est de la région Néarctique, soit du nord-est des États-Unis vers l’Ontario et le Québec au Canada, jusqu’au sud des États-Unis. Sa limite à l’ouest étant le Nebraska (Ratcliff, 1991) (Figure 7).
Cycle de vie
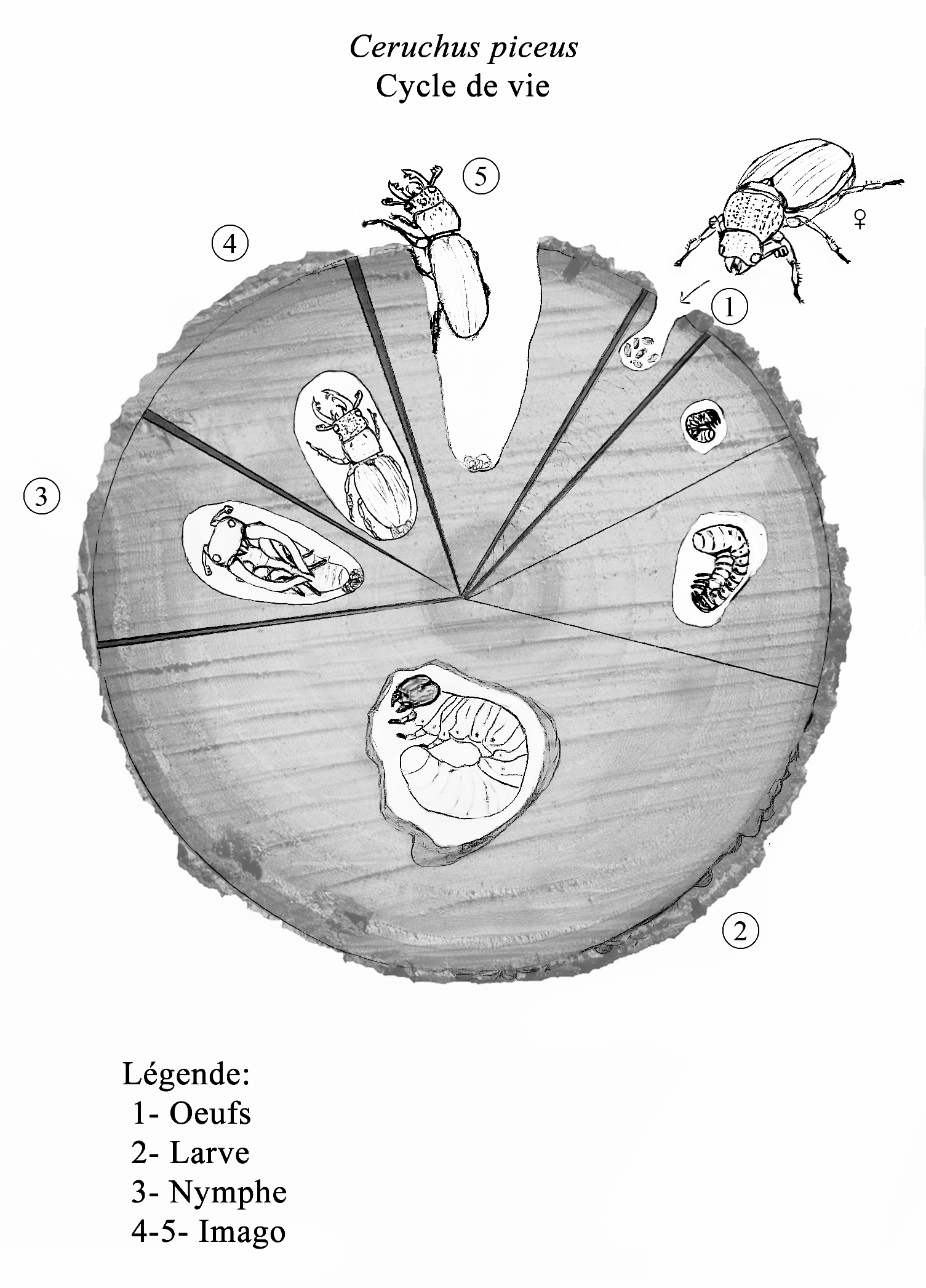
Bien que le cycle de vie de Ceruchus piceus soit peu documenté, celui de la famille Lucanidae est connu et varie peu d’une espèce à l’autre. Celui-ci se passe principalement dans le bois en décomposition des forêts de conifères ou de feuillus (Ratcliffe, 1991). Les Lucanidés sont des décomposeurs qui contribuent au cyclage naturel des nutriments dans l’écosystème forestier. Leur cycle de vie est caractérisé par un stade larvaire prolongé, variant jusqu’à 6 ans, selon l’espèce et le climat. Un hiver ou un printemps plus froid peut ralentir le développement larvaire et donc le cycle au complet. Ainsi, le cycle de vie (Figure 8) peut être considéré comme le suivant :
(1) Suite à l’accouplement, l’imago femelle va chercher un arbre en décomposition qui lui semble adapté pour y déposer ses œufs. La ponte se fait généralement dans une crevasse d’écorce dans laquelle l’imago femelle creuse afin de préparer le nid (Ratcliffe, 1991). Peu de temps après sa ponte elle meurt.
(2) L’éclosion des œufs prend environ trois semaines à un mois. Les larves sont xylophages, c’est-à-dire qu’elles se nourrissent de bois. Puisqu’il est difficile à digérer, les larves vivent en symbiose avec des micro-organismes dans leur système digestif qui les aident à le dégrader (Marshall, 2003). La larve naît aveugle avec un corps de couleur crème et une tête distincte de ses mandibules. Elle a aussi un organe de stridulation au niveau de ses pattes qu’elle utilise pour communiquer avec les autres larves (Ratcliffe, 1991). Étant donné qu’elle a une tête sclérifiée, donc rigide, la larve doit muer deux fois afin de pouvoir grandir. La première mue devrait se produire avant le début de l’hiver, selon la qualité du bois. Environ un an plus tard, elle réalise sa deuxième mue pour atteindre son troisième et dernier stade larvaire. Comme il y a peu de nutriments dans le bois, ce stade est le plus long, s’étale sur plusieurs années (Marshall, 2003), et il lui sert à préparer des réserves de graisse pour sa vie d’imago. Au cours de ces années, la larve aura eu le temps de creuser de nombreuses galeries d’alimentation dans l’écorce.
(3) Lorsque ses réserves sont suffisantes et que l’été est arrivé, la larve arrête de se nourrir et se prépare une chambre à l’aide de bois décomposés pour faire sa nymphose (Chu et Cutkomp, 1992). Chez certaines autres espèces de la même famille Lucanidae, comme Lucanus cervus, les larves migrent vers le sol pour faire leur nymphose (Marshall, 2003). Cependant, bien que ce stade n’ait pas été décrit pour Ceruchus piceus, nos observations sur le terrain indiquent que pour cette espèce cette étape se produit dans une souche de bois en décomposition (Figure 2). La nymphe restera enfouie pendant approximativement 3 mois avant de devenir adulte. Cette étape est le moment le plus vulnérable de la vie d’un Lucanidé.
(4) La mue imaginale, c’est-à-dire la dernière mue pour atteindre son stade final, se produit à la fin de l’été jusqu’au début de l’automne. L’imago passera l’hiver au sein de sa chambre dans le bois avant d’en émerger à la fin du printemps suivant (Harvey, 2007) (Figure 2).
(5) L’imago va se frayer un chemin jusqu’à l’air libre à l’aide de ses mandibules et de ses pattes prothoraciques. Ensuite, il vivra le temps d’une saison, un temps court qu’il devra optimiser pour la reproduction et la continuité de l’espèce. Les imagos sont plus actifs à la tombée de la nuit où ils sont mieux protégés contre les prédateurs. C’est à ce moment qu’il est le plus probable d’observer des mâles se battre avec leurs mandibules, dans le but de s’accoupler avec une femelle. En général, ils ne mangent pas, mais ils peuvent se nourrir de la sève de certains arbres ou du nectar de fleurs (Arnett et al., 2002).
Adaptation au froid
Ceruchus piceus possède une adaptation particulière pour survivre aux hivers rigoureux du nord-est de l’Amérique du Nord. L’adaptation la plus commune pour les insectes dans l’hémisphère nord est la tolérance au gel par la production de molécule antigel pendant la période hivernale (Sinclair et Chown, 2005). Cependant, ce n’est pas le cas de Ceruchus piceus, qui évite le gel inoculatif initié par la glace externe à travers la cuticule en supprimant les noyaux glacigènes (molécules favorisant la formation de cristaux de glace) (Dumans, 2001).
Cela lui permet de diminuer son point de surfusion d’approximativement 20°C, c’est-à-dire que l’eau présente dans son corps peut descendre à des températures inférieures à son point de fusion sans se solidifier. Cela est possible en supprimant un type de lipoprotéines spécifiques (LPINs, transporteurs de lipides) de l’hémolymphe et du tube digestif. La suppression des LPINs n’engendre aucun problème pour C. piceus, car elles sont moins utiles en hiver. En effet, à cause des basses températures, l’insecte entre en diapause, qui induit une réduction de l’activité métabolique. Deux hormones impliquées dans ce phénomène ont été identifiées : l’hormone adipokinetic (AKH) et l’hormone juvénile (JH). AKH augmente l’activité des noyaux glacigènes par la libération de LPINs alors que JH permet de la diminuer (Xu et al., 1990). La suppression des noyaux glacigènes est une alternative plus favorable énergétiquement que la production de molécules antigel, qui doivent se retrouver en grande concentration dans l’organisme pour être efficace (Neven et al., 1986).
Bibliographie
Arnett, R.H., Jr. 1968. The Beetles of the United States. A Manual for Identification. The American Entomological Institute, Ann Arbor, MI. 1112 pp.
Arnett, R.H., Jr., M.C. Thomas, P.E. Skelley et J.H. Frank. (eds.). 2002. American Beetles, Volume II: Polyphaga: Scarabaeoidea through Curculionoidea. CRC Press LLC, Boca Raton, FL. Family 23 Lucanidae: 6-8.
Blatchley, W.S. 1910. Coleoptera or Beetles Known to Occur in Indiana. Nature Publishing Co., Indianapolis, Ind. 1385 pp.
Chu, H.F. et L.K. Cutkomp. 1992. How to Know the Immature Insects. Wm. C. Brown Publishers, Dubuque, Iowa. 346 pp.
Daggy, T. 1946. The Ecology and Taxonomy of the Immature Stages of Certain Wood-inhabiting Coleoptera of the Chicago Region. Ph. D. diss., Northwestern University
Dumans, J.G. 2001. Antifreeze and ice nucleator proteins in terrestrial arthropods. Annual Review of Physiology 63: 327-357.
Hardy, M. 2014. Guide d’identification des Scarabées du Québec (Coleoptera : Scarabaeoidea). Entomofaune du Québec (EQ) inc., Saguenay, 166 pp.
Harvey, D.J. 2007. Aspects of the biology and ecology of the stag beetle (Lucanus cervus (L). Unpublished PhD thesis, University of London, UK.
Hoffman, C.H. 1937. Biological notes on Pseudolucanus placidus Say, Platycerus quercus Weber and Ceruchus piceus Weber (Lucanidae-Coleoptera). Entomological News 48: 281-284.
Marshall, C. 2003. Insects and Spiders of the World, Volume 8. Stag Beetle: 499-501.
Neven, L.G., J.G. Duman, J.M. Beals et F.J. Castellino. 1986. Overwintering adaptations of the stag beetle Ceruchus piceus: Removal of ice nucleators in the winter to promote supercooling. Journal of Comparative Physiology, B 156 (5):707-716.
Ratcliffe, B.C. 1991. The Lucanidae and Passalidae (Insecta: Coleoptera) of Nebraska. Great Plains Research 1: 249-282.
Savage, C. 2001. Recolonisation forestière dans les Basses Laurentides au sud du domaine climacique de l’érablière à bouleau jaune. Université de Montréal, Montréal, 51 pp.
Sinclair B.J. et S.L. Chown. 2005. Climatic variability and hemispheric differences in insect cold tolerance: support from southern Africa. Functional Ecology 19:214-221.
Scholtz, C.H. 1990. Phylogenetic trends in the Scarabaeoidea (Coleoptera). Journal of Natural History 24: 1027-1066.
VanDyk, J. 2015. BugGuide. [Online]. Iowa State University, departement of entomology. <URL : http://bugguide.net/>
Xu, L., L.G. Neven, et J.G. Duman. 1990. Hormonal control of hemolymph lipoprotein ice nucleators in overwintering freeze-susceptible larvae of the stag beetle Ceruchus piceus: adipokinetic hormone and juvenile hormone. Journal of Comparative Physiology, B. 160: 51-59.