Sympetrum obtrusum (Hagen 1867)
Sympétrum éclaireur
Par Miguelly BÉLANGER, Daphnée LECOURS-TESSIER et Étienne R.-DIONNE
Texte et photographies ©2016 CC BY-SA 4.0, les auteurs
Photos réalisées par Étienne R.-Dionne
Croquis et carte réalisés par Miguelly Bélanger

Identification, classification et morphologie

Frappante, la couleur blanche du front des mâles est l’une des caractéristiques principales permettant de distinguer S. obtrusum parmi les espèces du genre Sympetrum, d’où leur nom vernaculaire “White-faced Meadowhawk”.
Généralement, les individus de cette espèce mesurent de 30 à 35mm. Ils ont les ailes claires. Mâles et femelles présentent un certain dimorphisme. En effet, les femelles n’ont pas le front blanc caractéristique des mâles ni l’abdomen teinté de rouge. Celles-ci, comme les juvéniles, ont plutôt la face d’une couleur qui tire sur le jaune, le brun ou le vert, ainsi qu’un abdomen cendré, ce qui les rend difficiles à distinguer de S. rubicundulum et S. internum (Dunkle, 2000).
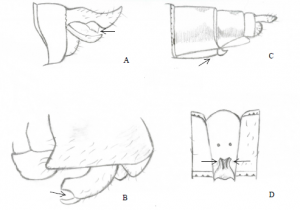
Comme les S. obtrusums, le spécimen capturé possède une face blanche. Cependant, ce sont les appendices anaux supérieurs de l’extrémité de l’abdomen ainsi que l’échancrure de l’hameçon du 2e segment de l’abdomen qui a permis de confirmer son identification (Robert, 1963).
De plus, la position médiane du nodus ainsi que la disposition des nervures principales du supertriangle de l’aile postérieure de notre spécimen sont typiques des Sympetrum (Pilon & Lagacé, 1998). Appartenant également à la famille des libellulidés, leurs ailes postérieures présentent un champ anal en forme de pied possédant un « orteil » plutôt développé. Qui plus est, l’asymétrie de la base des ailes antérieures et postérieures (la base des ailes antérieures étant plus large que celle des ailes postérieures) corrobore l’appartenance au sous-ordre des anisoptères (Silsby, 2001).
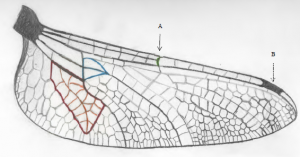
Dans une perspective d’ensemble, les libellules présentent plusieurs caractéristiques distinctives (Pilon & Lagacé, 1998). Elles ont de courtes antennes. Leurs yeux composés sont de si grandes tailles par rapport au volume de leur tête, qu’ils se rejoignent au sommet de la capsule céphalique. Ils possèdent un long et mince abdomen. Leur thorax orienté vers l’avant permet une capture de proies efficace, en les emprisonnant dans leurs pattes. Au repos, les ailes se posent à plat. Leurs larves possèdent un masque labial étonnant, leur permettant d’atteindre leurs proies avec grande vélocité (Kalkman & al., 2000). Voici un ensemble de caractères partagés par l’espèce du spécimen capturé.

Les libellules à travers les âges et les continents
Répartis sur l’ensemble de la planète depuis des millénaires, les odonates ont intéressé les hommes et suscité une fascination culturelle à travers les âges (Pilon, 1998). Venant du grec ancien, le mot « odonata » fut créé par Fabricius (1793) pour désigner les « mandibules munies de dents », alors que le mot « Anisoptera » souligne l’asymétrie des ailes (Pilon & Lagacé, 1998). Ceci dit, c’est Linné (1758) qui a introduit le terme « libellules ». En extrême Orient, les libellules sont plutôt bien considérées. Elles y ont d’ailleurs longtemps été utilisées pour traiter les inflammations de la gorge. Au Japon, elles symbolisent la force, la bravoure et la victoire. En Europe, au contraire, ces insectes sont considérés comme maléfiques, une croyance populaire probablement tirée du moyen âge. Pour cette raison, ils se faisaient même appeler « tire-z’yeux » ou « crève-œil » (d’Aguilar, 1985). Plus près d’ici, on a souvent considéré à tort les libellules comme des insectes piqueurs. Aujourd’hui encore, les libellules suscitent un certain engouement.
Évolution

Apparus durant la période du carbonifère, les Protodonata sont peut-être les ancêtres des Odonates. Datant du permien, les libellules sont parmi les plus anciens insectes volants (paléoptère) (Grimaldi, D. et Engel, 2005). Dans le même taxon, Protodonata, se trouve le plus grand insecte connu à ce jour (Méganeuropsis permiana), d’une envergure d’ailes de 70cm (Beckemeyer, 2000). Des fossiles de zygoptères et d’anisoptères (Odonata au sens strict) ont d’abord été trouvés au Mésosoïque: les premiers fossiles d’anisoptères modernes datent du Trias (Silsby, 2001). Ceux-ci auraient donc déjà été présents avant que la Pangée se soit complètement disloquée! Émergeant de cette lignée, les libellulidés sont apparus lors de l’Éocène. Avec leurs ailes puissantes et leur corps effilé, leurs ancêtres ont pu bénéficier d’un avantage évolutif important, leur permettant de se distribuer sur un large territoire. À ce jour, on compte près de 7000 espèces d’Odonates (Kalmman & al., 2008) et plus de 60 espèces de Sympetrum à travers le monde (Pilgrim & Dohlen, 2007).
Répartition et habitat
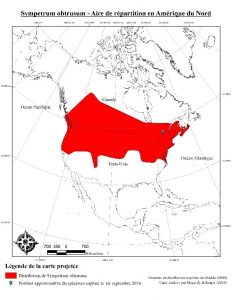
Espèce indigène de l’Amérique du Nord, Sympetrum obtrusum se retrouve dans la région zoogéographique Néarctique. Il est principalement recensé au sud du Canada et au nord des États-Unis, mais semble absent du Yukon et du sud de l’Amérique du Nord (Dunkle, 2000; Catling, 2003). Dans ces territoires, il occupe une variété de milieux humides (étangs, lacs, cours d’eau lentiques) et spécialement les tourbières et les marais (Pilon et Lagacé, 1998). Considérant la dispersion des adultes à partir des étendues d’eau, certains avancent que les individus matures constituent une population distincte de celle des larves, malgré le fait que l’un et l’autre occupent les mêmes zones (Faydenko, 2013).
Cycle de vie et alimentation
Essentiels au développement des libellules, les points d’eau douce permettent le développement de leurs œufs et de leurs larves (Kalkman et al., 2008). Généralement, les œufs éclosent environ trois semaines après la ponte, sauf ceux pondus à la fin de la saison estivale, qui tombent en dormance durant l’hiver (Silsby, 2001). C’est d’ailleurs sous forme d’œufs que les embryons de Sympetrum obtrusum passent l’hiver, pour voir leurs larves éclore au printemps et les adultes émerger fin juin, début juillet (Walker & Corbet, 1975). Ainsi, deux générations se succéderont chaque année. Après éclosions, plusieurs stades larvaires s’enchaineront, entrecoupées de mues. Chez les libellules, le premier stade (stade protolarvaire) est caractérisé par l’absence de patte et ne dure qu’une courte période de temps (de quelques secondes à quelques heures) (Silsby, 2001). Par suite, certaines larves de libellules seront plus passives et d’autres plus actives dans leur comportement de chasse, mais toutes sont prédatrices. Grâce à leur masque labial, qui leur permet d’attraper leurs proies à grande vélocité, les larves des Odonates arrivent à se saisir d’insectes, de têtards et même de petits poissons (Corbet, 1999).
| Video 1 : Larve de libellule se nourrissant d’une larve de coléoptère à l’aide de son masque labial (par Derek Wheaton, 2015). CC BY-SA 4.0 |
Contrairement à certains autres genres, le genre Sympetrum consomme non seulement des proies à chacun de ses stades larvaires, mais passe aussi la majeure partie de son cycle de vie sous l’eau (Pritchard, 1964; Corbet, 1999). Les larves de libellules prennent de quelques semaines à quelques années pour se développer, selon l’espèce et différents facteurs environnementaux, tel que la température de l’eau et la quantité de nourriture disponible (Corbet, 1999; Silsby, 2001). Au dernier stade larvaire avant la métamorphose, les derniers organes vitaux finissent de se développer et la larve se prépare pour une dernière mue. L’émergence des libellules matures se fait à l’extérieur de l’eau, sur la végétation ou sur la rive, au courant de la nuit ou au matin, lorsque l’air a pu se réchauffer (Silsby, 2001).
| Video 2 : Émergence d’une libellule après métamorphose (auteur inconnu, 2010). CC BY-SA 4.0 |
Après avoir quitté leur site d’émergence, les libellules occupent la majeure partie de leur temps à chasser, principalement des diptères et de petits insectes volants (Pilon & Lagacé, 1998; Dunkle, 2000). Avec les zygoptères, les libellulidés se distinguent des autres Odonates de par leur Le sympétrum éclaireur démontre une (édité 2018-01-22) mode de chasse à l’affût, repérant leurs proies à partir d’un perchoir, avant de se jeter sur elles (Pilon & Lagacé, 1998). En une seule journée, une libellule peut ainsi consommer jusqu’au cinquième de son poids (Powell & Twist, 1999). Selon les conditions, les libellules en développement auront besoin d’une semaine à un mois pour s’alimenter. Une période cruciale où elles se disperseront afin d’acquérir l’énergie suffisante au développement de leurs organes sexuels (Aguesse,1968; Corbet, 1952). À la recherche de ressources, les mâles Sympetrum obtrusum sont très abondants dans les prairies de Carex. Lors de cette phase de développement, il est possible d’y en observer plus d’un par 10 pi2 (Paulson, 2011) ! Ce n’est qu’en tant qu’individu mature que les mâles et femelles retourneront près de points d’eau pour s’accoupler (Corbet, 1999).
Reproduction
Chez les libellules, le mécanisme de transfert de sperme est indirect (Kalkman, 2008). Après avoir été produit dans les testicules, situés au bout de l’abdomen, le sperme est transféré de manière externe à l’organe copulatoire mâle, à la base de l’abdomen. Grâce à un hameçon, le mâle retient l’abdomen de la femelle durant la copulation. Ainsi, il insémine la femelle et en profite même pour retirer le sperme de ses compétiteurs. Cette compétition spermatique chez les Odonates a été reportée pour la première fois par Waage (1979). Aujourd’hui, c’est ce qui en fait l’un des groupes animaux les plus étudiés pour leur comportement reproducteur (Kalkman, 2008). Suite à la copulation, le mâle reste accroché à la femelle jusqu’à la ponte (Silsby, 2001). Les perforations sur l’une des extrémités des œufs oblongs permettent aux spermatozoïdes de les pénétrer. Puis, les œufs sont ensuite rapidement relâchés à la surface de l’eau ou sur le sol environnant, la femelle ayant un ovipositeur vestigial.
Utilité pour l’homme et statut de conservation
Très sensibles à la qualité de leur habitat et aux perturbations environnementales, les libellules sont souvent utilisées pour évaluer l’ampleur des changements environnementaux, sur le court et le long terme. Aussi, elles sont utilisées comme bioindicateurs de la santé de l’écosystème, dans les projets de conservation et de restauration (Kalman, 2008; Clark & Samways, 1996). Le réchauffement climatique, l’agriculture, l’introduction d’espèce exotique, l’urbanisation et plus encore, entraînent cependant la dégradation et la perte de diversité des milieux humides, dont dépendent les Odonates (Hassall & Thompson, 2008; Kadoya & al., 2009; Rodriguez & al., 2005). De fait, certaines espèces de libellules sont aujourd’hui dans une situation critique (Suh & Samways, 2005; Hämäläinen, 2004). Considérant la large gamme d’organismes interagissant avec les libellules, que ce soit au stade larvaire ou adulte, il est d’autant plus important de protéger les milieux humides, dont ils dépendent.
Bibliographie
| Beckemeyer RJ. 2000. The Permian insect fossils of Elmo, Kansas. Emporia State University.
Bulankova E. 1997. Dragonflies (Odonata) as bioindicators of environment quality. Biologia, Bratislava 52:177-180. Catling PM. 2003. Dragonflies (Odonata) of the Northwest Territories: Status Ranking and Preliminary Atlas. Northwest Territories, Environment and Natural Resources. Clark TE, Samways MJ. 1996. Dragonflies (Odonata) as indicators of biotope quality in the Kruger National Park, South Africa. Journal of applied ecology:1001-1012. Cohen K, Finney S, Gibbard P, Fan J-X. 2013. The ICS international chronostratigraphic chart. Episodes 36:199-204. Corbet PS. 1952. An adult population study of Pyrrhosoma nymphula (Sulzer):(Odonata: Coenagrionidae). The Journal of Animal Ecology:206-222. Corbet. 1999. Dragonflies: behaviour and ecology of Odonata. Harley Books. Cresswell S, Block N. 2016. Species Sympetrum – White-faced Meadowhawk. (2016; http://bugguide.net/node/view/8056) d’Aguilar J, Dommanget J-L. 1985. Guide to the dragonflies of Europe and North Africa. Delachaux et Niestlé. Dunkle SW. 2000. Dragonflies through binoculars: a field guide to dragonflies of North America. Oxford University Press. Fabricius JC. 1793. Entomologia systematica emendata et aucta. Faydenko JL, Butler LM, Swanson BJ. 2013. As the Dragon Flies: Population Structure in Sympetrum obtrusum Dragonflies. Grimaldi D, Engel MS. 2005. Evolution of the Insects. Cambridge University Press. Hagen H. 1867. Revision der von Herrn Uhler beschriebenen Odonaten. Stett. Ent. Ztg. 28: 87–95. Sympetrum obtrusum. Hämäläinen M. 2004. Critical species of Odonata in the Philippines. International Journal of Odonatology 7:305-310. Hassall C, Thompson DJ. 2008. The effects of environmental warming on Odonata: a review. International Journal of Odonatology 11:131-153. Kadoya T, Suda S-i, Washitani I. 2009. Dragonfly crisis in Japan: a likely consequence of recent agricultural habitat degradation. Biological Conservation 142:1899-1905. Kalkman VJ, Clausnitzer V, Dijkstra K-DB, Orr AG, Paulson DR, van Tol J. 2008. Global diversity of dragonflies (Odonata) in freshwater. Hydrobiologia 595:351-363. Labhart T, Nilsson D-E. 1995. The dorsal eye of the dragonfly Sympetrum: specializations for prey detection against the blue sky. Journal of Comparative Physiology A 176:437-453. Paulson D. 2011. Dragonflies and Damselflies of the East. Princeton University Press. Perron J, Jobin L, Mochon A. 2005. Odonatofaune du parc national de la Yamaska, division de recensement de Shefford, Québec. Le Naturaliste canadien 129:17-25. Pilgrim EM, Von Dohlen CD. 2007. Molecular and morphological study of species-level questions within the dragonfly genus Sympetrum (Odonata: Libellulidae). Annals of the Entomological Society of America 100:688-702. Pilon J-G, Lagacé D. 1998. Les odonates du Québec: traité faunistique. Entomofaune du Québec. Powell D, Twist C. 1999. A guide to the dragonflies of Great Britain. Arlequin Press. Pritchard G. 1964. The prey of dragonfly larvae (Odonata; Anisoptera) in ponds in northern Alberta. Canadian Journal of Zoology 42:785-800. Robert A. 1963. Les libellules du Québec. Québec: Station biologique du Mont Tremblant, Service de la recherche, Ministère de la chasse et des pêcheries, 1963, 1966 printing. Rodríguez C, Bécares E, Fernández-Aláez M, Fernández-Aláez C. 2005. Loss of diversity and degradation of wetlands as a result of introducing exotic crayfish. Biological Invasions 7:75-85. Silsby J. 2001. Dragonflies of the World. Csiro publishing. Suh AN, Samways MJ. 2005. Significance of temporal changes when designing a reservoir for conservation of dragonfly diversity. Biodiversity & Conservation 14:165-178. Waage JK. 1979. Dual function of the damselfly penis: sperm removal and transfer. Science 203:916-918. Walker E, Corbet P. 1975. The Odonata of Canada and Alaska. Vol. 3, Part III: The Anisoptera—Three Families: Toronto: University of Toronto Press.
|