Ceuthophilus pallidipes (Walker 1905)
par Alexis DUPRÉ, Caroline FINK-MERCIER et David POISSANT
Texte et photographies au domaine public CC0 1.0, les auteurs
Classement
Classe : Insecta
Ordre : Orthoptera
Sous-ordre : Ensifera
Superfamille : Rhaphidophoroidea
Famille : Rhaphidophoridae
Genre : Ceuthophilus
Espèce : pallidipes
Identification
Quelques critères d’identification clés permettant rapidement de passer de l’identification à l’ordre jusqu’au genre, puis à l’espèce. Voici une identification pas à pas pour un-e entomologiste débutant-e mais enthousiaste!
D’abord, les longues pattes modifiées pour le saut et le pronotum élargi et en forme de selle indiquent que le spécimen fait partie de l’ordre des Orthoptera, puis les longues antennes indiquent normalement que l’espèce se classe parmi le sous-ordre Ensifera, plutôt que Caelifera. L’allure courbé de l’abdomen et l’absence d’ailes classe ensuite le spécimen dans la famille des Rhaphidophoridae. Cette famille est répandue à travers le monde et favorisée dans les endroits frais et humides, par exemple sous les roches, où le spécimen à d’ailleurs été trouvé (Department of Entomology of Iowa State University, 2017). La forme du corps, sa couleur brunâtre et sa taille (qui peut aller jusqu’à 1 1/2 ») indiquent que le spécimen fait partie du genre Ceuthophilus, qui regroupe les espèces communément appelées camélines (University of Arkansas, 2002). Un bon guide d’identification est recommandé pour identifier le spécimen à l’espèce. Attention, bien que Ceuthophilus maculatus soit l’espèce la plus répandue dans le sud du Québec, le spécimen récolté correspond à Ceuthophilus pallidipes (Vickery et al., 1985). Seul-es les entomologistes rigoureux sauront faire la différence. Voici les critères clés de l’espèces:
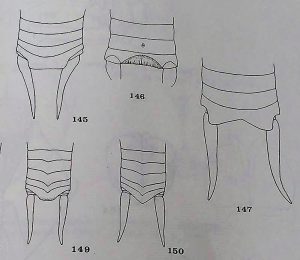
Cette espèce de grillon est assez petite et grêle avec des pattes et des antennes assez longues. Le 9e tergite du mâle est de forme quadrangulaire (voir schéma de la figure 2), très sclérotisé et est souvent tourné vers le haut (voir figure 1). Les deux critères les plus facilement discriminants sont les épines de la partie dorsale du tibia qui sont noircies à la base, ainsi que la ligne médiane plus pâle sur le thorax (Vickery et al., 1985).

- Épines de la partie dorsale du tibia noircies à la base
- Ligne médiane plus pâle bien définie sur le thorax
- 9e tergite du mâle quadragulaire
- Longues antennes (critère plus général du sous-ordre Ensifera)
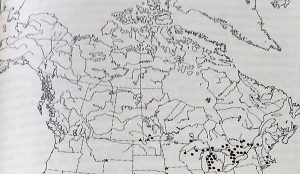
Répartition géographique
Ceuthophilus pallidipes est surtout présent près des Grands Lacs, mais peut également atteindre les Laurentides, qui est d’ailleurs l’endroit où le spécimen a été récolté. L’espèce peut facilement être confondue avec Ceuthophilus maculatus, qui est très abondant dans la région des Laurentides. Un œil aiguisé est indispensable pour identifier C. pallidipes (Vickery et al. 1985).
Le mode de vie
Habitat
Le genre Ceuthophilus est d’un groupe d’insectes pour la plupart trogloxènes c’est-à-dire qu’ils se réfugient dans les grottes, mais que la plupart de leurs activités vitales se déroulent à l’extérieur (Lavoie et al., 2007). En effet Ceuthophilus spp. ne supportent pas les conditions sèches et les températures élevées et se tiennent donc à l’obscurité durant le jour (Eades D., 1964, Lavoie et al., 2007). Il existe toutefois une variabilité importante dans le degré de dépendance de certaines espèces appartenant au groupe Ceuthophilus aux grottes (Lavoie et al., 2007). Par exemple, certaines espèces, tel que C. conicaudus au Texas, restent dans les grottes pour la majorité de leur vie et y déposent même leurs œufs; elles ne sortent que la nuit pour s’alimenter (Lavoie et al., 2007). D’autres espèces plus au Nord, par exemple C. guttulosus, se cachent plutôt sous les roches ou la litière durant le jour; l’humidité du sol est suffisante pour les garder à l’abri (Eades D., 1964). À mi-chemin, C. stygius, au Kentucky, mange et pond ses œufs dans la forêt, mais s’abrite dans les caves durant la journée (Lavoie et al., 2007).
En général, les espèces les plus adaptées aux caves ont un taux métabolique faible et une cuticule très mince; ce faible taux métabolique leur permet de survivre plusieurs jours sans manger. Elles ne sortent que lorsque la température et le niveau d’humidité sont appropriés (Lavoie et al., 2007). Les espèces dont le taux métabolique est plus élevé et dont la cuticule est plus épaisse se retrouvent moins en profondeur dans les caves. Ils ne peuvent passer que quelques jours sans manger et doivent donc sortir plus fréquemment pour s’alimenter. Leur anatomie leur permet toutefois de mieux résister aux conditions externes (Lavoie et al., 2007). Étant donné que les espèces étroitement liées aux caves sont très sensibles aux variations de température et d’humidité, elles sont particulièrement vulnérables dans le contexte des changements climatiques (Lavoie et al., 2007).
Ceuthophilus pallidipes est principalement actif la nuit et se retrouve sous les arbres morts et autres débris du sol (Vickery et Kevan, 1986). Il est à noter que l’un de nos spécimens de C. pallidipes a été trouvé en plein jour sous une roche. Il s’agit d’une espèce plutôt active en général qui a d’ailleurs déjà été récoltée à plus de deux mètres au-dessus du sol sur le mur des habitations ou sur les troncs (Vickery et Kevan,1986).
Alimentation :
L’alimentation de Ceuthophilus a rarement été observée (Taylor et al., 2005). Ils cherchent leur nourriture la nuit lorsque la luminosité, la température et le niveau d’humidité sont appropriés (Lavoie 2007). Ils utilisent leur odorat afin de trouver leur nourriture (Lavoie 2007). En général, les espèces habitant les grottes restent à moins de 100m de l’entrée de leur grotte pour chercher de la nourriture (Taylor et al., 2005). Ceuthophilus sont des détritivores opportunistes ou des omnivores. Certaines espèces mangent des fruits, de l’avoine, d’autres insectes morts et du pain. D’autres espèces de Ceuthophilus ont été observées s’alimentant de carcasses de bassaris rusé, de matières fécales humaines, de lépidoptères et des œufs d’autres insectes (Taylor et al., 2005).
Prédation :
Ceuthophilus a de nombreux prédateurs. Les araignées et les salamandres qui habitent les caves s’attaquent fréquemment aux adultes (Lavoie et al., 2007). La prédation est encore plus importante lorsqu’ils recherchent de la nourriture la nuit, particulièrement par les souris (Lavoie et al., 2007). De plus, leurs œufs sont souvent la proie des scarabées habitant les caves (Taylor et al., 2005)
Reproduction et cycle de vie :
Le genre Ceuthophilus fait partie du taxon paraphylétique Hemimetabola, c’est-à-dire qu’il subit une métamorphose incomplète pendant son développement. Une fois l’œuf éclot, la larve subit un nombre de mues défini, bien que le nombre précis soit inconnu pour cette espèce, avant de devenir adulte. Au contraire des holométaboles, la larve des hémimétaboles ressemble à l’adulte dès sa sortie de l’œuf. Parmi les différences observables, on note, par exemple, une plus petite taille, une pigmentation plus faible et l’absence de certaines caractéristiques sexuelles (Lavoie et al., 2007).
La reproduction est assez variable entre les espèces appartenant au genre Ceuthophilus. Certaines espèces au Nouveau-Mexique seraient en mesure de se reproduire à longueur d’année. La production d’œufs chez les femelles varie toutefois quantitativement de façon saisonnière (Lavoie et al., 2007). En général, les espèces affichant une plus grande adaptation aux grottes pondent des œufs en moins grande quantité, mais ils sont plus gros (Lavoie et al., 2007). Des conduits souterrains entre cavernes seraient en mesure de préserver la diversité génétique des espèces dont la dispersion est limitée par leur sensibilité aux conditions extérieures (Lavoie et al., 2007).
D’autres espèces ont des périodes de ponte plus distinctes. C’est le cas de notre espèce Ceuthophilus pallidipes, dont la reproduction se fait principalement en août et en septembre. Les œufs sont pondus durant l’hiver et éclosent au printemps. Les larves atteignent le stade adulte à la moitié de l’été (Luong et Hudson, 2012).
Le rituel de reproduction a rarement été décrit chez le genre Ceuthophilus; une des rares mentions dans la littérature concerne l’espèce C. guttulosus par David C. Eades . Chez cette espèce, les antennes du mâle et de la femelle doivent se toucher. S’ils se reconnaissent, les individus vont exhiber une réponse positive. Les deux individus font volte-face; la femelle soulève son abdomen tandis que le mâle va reculer à vitesse constante en balayant ses cerques pour détecter un objet rond (dans le meilleur des cas la femelle). Lorsqu’il fait contact, le mâle tord son abdomen, de sorte qu’il soit presque à l’envers, et va tenter d’insérer ses pièces génitales dans la femelle, par essai-erreur. Ce rituel de reproduction se passe dans l’obscurité et occasionne ainsi certaines erreurs. Dans certains cas, l’un des deux individus n’a pas été assez stimulé par le contact entre les antennes et va donc continuer son chemin. L’individu stimulé va souvent continuer de scruter le territoire avec ses antennes dans l’espoir de retrouver son/sa partenaire (Eades, 1964).
Les intérêts scientifiques
Le genre Ceuthophilus fait partie de certains points chauds dans le domaine de la science.
Ceuthophilus sp. comme espèce clé de voûte dans les écosystèmes souterrains.
Le genre Ceuthophilus a principalement été étudié pour son rôle écologique dans les grottes. Les grottes sont des écosystèmes présentant des conditions hostiles, notamment des taux d’humidité très élevés, l’absence de lumière ainsi que la sporadicité de la nourriture (Bernabo et al., 2011). Dans les grottes assez volumineuses, le guano des chauves-souris est l’apport d’énergie principale des écosystèmes souterrains. Dans les grottes plus petites où les chauves-souris sont absentes, ce sont les espèces du genre Ceuthophilus qui ont ce rôle (Taylor et al., 2005). En effet, Ceuthophilus fournit de l’énergie sous forme d’excrément, d’œufs ou encore de carcasse (Taylor et al., 2005). Pour les araignées et les scarabées prédateurs, la santé des populations de Ceuthophilus est nécessaire à leur survie. Les arthropodes troglophiles, c’est-à-dire ceux qui ne quittent jamais les grottes, sont très vulnérables, car ils ne dépendent que de quelques espèces assurant le transfert d’énergie de la surface au milieu sous-terrain. Les espèces de Ceuthophilus sont donc des espèces clé de voûte dans ce contexte (Lavoie et al., 2007).
Parenthèse : Certaines espèces de Ceuthophilus ont une relation évolutive très étroite avec leur prédateur dans les écosystèmes souterrains. C’est le cas d’une espèce de Ceuthophilus au Texas qui a développé un long ovipositeur pour enfouir ces œufs plus en profondeur afin d’augmenter leurs chances de ne pas être découvert par les scarabées (Lavoie 2007).
Ceuthophilus pour étudier la phylogéographique
Les écosystèmes se retrouvant dans les grottes sont parfois comparables à certains égards aux écosystèmes d’îles dans l’océan ; les espèces qu’on y retrouve sont isolées géographiquement et souvent endémiques (Weckstein et al., 2016). Ainsi, les grottes sont des écosystèmes relativement simples permettant d’étudier les processus évolutifs expliquant la dispersion géographique et la spéciation des espèces (Juan et al., 2010).
Les espèces plutôt trogloxènes que troglophiles pouvant couvrir de plus grandes distances, les échanges de gènes entre populations sont plus fréquents. Les populations des espèces troglophiles affichent donc une différenciation génétique plus importante que les espèces trogloxènes, car la dispersion génétique est plus ardue. L’histoire est toutefois plus complexe, car la géologie des caves joue un rôle. En bref, les caves ayant des structures très fissurées permettent un échange régulier de gènes entre les populations d’espèces troglophiles (Weckstein et al., 2016).
Tel que mentionné précédemment, il existe un large éventail de degré d’association aux grottes au sein du genre Ceuthophilus. En effet, le sous genre Ceuthophilus exhibe des espèces pouvant de déplacer de 1 km pour changer de caves alors qu’aucune dispersion n’a jamais été documentée pour le sous-genre troglophile Geotettix (Weckstein et al., 2016). L’étude du genre Ceuthophilus est donc idéale afin d’évaluer le rôle de la dispersion et le degré d’adaptation aux cavernes dans la génération de différences phylogéographiques d’espèces reliées étroitement phylogénétiquement et occupant le même territoire. (Weckstein et al., 2016)
Ceuthophilus pallidipes comme vecteur de parasites
De retour à notre espèce. Peu d’études se sont concentrées sur Ceuthophilus pallidipes, notamment car il ne représente pas les mêmes intérêts scientifiques mentionnés plus haut. Ceuthophilus pallidipes a toutefois été identifié comme vecteur de transmission du parasite Pterygodermatis peromysci. P. peromysci est un nématode qui affecte les souris. L’adulte pond ses œufs qui sont relâchés à l’intérieur de la souris et sont donc répandus sous forme d’excréments. Étant donné que C. pallidipes est un détritivore, il consomme ces œufs. Les œufs de nématode se développent dans C. pallidipes. En s’alimentant d’un C. pallidipes infecté, la souris se retrouve alors hôte du parasite nématode. (Luong et Hudson, 2012)
Interactions avec les humains.
Le grillon est souvent présent dans les sous-sols de nos habitations puisque ce milieu sombre et humide est idéal pour lui (Epps et al., 2014). Bien qu’il soit inoffensif pour l’humain, les gens sont souvent réticents à cohabiter avec un insecte. Des espèces de Ceuthophilus provenant d’Asie sont en train d’envahir les maisons dans plusieurs régions des États-Unis. Stuart Aust, président de Bug Doctor, estime que la population de grillons des sous-sols dépasserait maintenant la population d’humain aux États-Unis.
Dans une certaine mesure, Ceuthophilus pourrait être bénéfique en mangeant les petits insectes morts et les miettes qui s’accumulent dans les recoins de nos maisons, mais son apparence est considérée comme répugnante par plusieurs personnes. Le meilleur moyen de se débarrasser de lui serait d’illuminer les endroits sombres de sa maison et de se munir d’un déshumidificateur.
Autrement, pour les gens qui pratiquent l’entomophagie, les orthoptères, notamment les grillons et les criquets, sont régulièrement désignés comme étant les meilleurs comestibles. Rien n’empêche de croire qu’il serait possible de se nourrir de C. pallidipes mais son alimentation omnivore, parfois coprophage, lui conférerait malheureusement un gout désagréable.
Référence :
Bernabò, L. Latella, O. Jousson, V. Lencioni, Cold stenothermal cave-dwelling beetles do have an HSP70 heat shockresponse, In Journal of Thermal Biology, Volume 36, Issue 3, 2011, Pages 206-208, ISSN 0306-4565, https://doi.org/10.1016/j.jtherbio.2011.03.002.
Eades, D. C. (1964). General biology and geographic variation of Ceuthophilus guttulosus Walker (Orthoptera: Gryllacrididae: Rhaphidophorinae). Transactions of the American Entomological Society (1890-), 90(1), 73-110.
Epps, M. J., Menninger, H. L., LaSala, N., & Dunn, R. R. (2014). Too big to be noticed: cryptic invasion of Asian camel crickets in North American houses. PeerJ, 2, e523.
Department of Entomology of Iowa State University. (2017). Identification, Images, & Information or Insects, Spiders & Their Kin for the United States & Canada. Repéré à : https://bugguide.net/node/view/73
Juan, C., Guzik, M. T., Jaume, D., & Cooper, S. J. (2010). Evolution in caves: Darwin’s ‘wrecks of ancient life’in the molecular era. Molecular Ecology, 19(18), 3865-3880.
Lavoie, K. H., Helf, K. L., & Poulson, T. L. (2007). The biology and ecology of North American cave crickets. Journal of Cave and Karst Studies, 69(1), 114-134.
Luong, L. T., & Hudson, P. J. (2012). Complex life cycle of Pterygodermatites peromysci, a trophically transmitted parasite of the white-footed mouse (Peromyscus leucopus). Parasitology research, 110(1), 483-487.
Taylor, S. J., Krejca, J. K., & Denight, M. L. (2005). Foraging range and habitat use of Ceuthophilus secretus (Orthoptera: Rhaphidophoridae), a key trogloxene in central Texas cave communities. The American midland naturalist, 154(1), 97-114.
University of Arkansas. (2002). Camel Cricket. Repéré à : https://entomology.uark.edu/outreach/arthropod-museum/camel-cricket.php
Vickery, V. R., & Kevan, D. K. (1985). The grasshoppers, crickets, and related insects of Canada and adjacent regions. Ulonata: Dermaptera, Cheleutoptera, Notoptera, Dictuoptera, Grylloptera, and Orthoptera (No. Part 14). Agriculture Canada.
Weckstein, J. D., Johnson, K. P., Murdoch, J. D., Krejca, J. K., Takiya, D. M., Veni, G., … & Taylor, S. J. (2016). Comparative phylogeography of two codistributed subgenera of cave crickets (Orthoptera: Rhaphidophoridae: Ceuthophilus spp.). Journal of Biogeography, 43(7), 1450-1463.